
新闻中心
【原创】常见血液肿瘤MRD检测时机怎么选?让我们看看指南怎么说
前 言
众所周知,造血干细胞移植是治疗恶性血液疾病及其他疾病的有效方式甚至是唯一方式,近些年随着移植体系及预处理方案的不断完善,越来越多的患者得到了很好的治愈并顺利回归社会。但是也有部分患者因为各种各样的并发症最终导致移植失败,其中复发仍然是一个重要的问题[1-2]。因此,尽早的发现复发并及时干预是十分重要的。
微小残留病灶(Minimal Residual Disease/Measurable Residue Disease, MRD)是指白血病患者获得完全缓解(CR)后体内残存的白血病细胞。越来越多的研究都证实了MRD监测在预测复发[3-4]、用药指导[5-7]、预后分层[8-10]等方面具有重要意义。随着技术的发展,灵敏度更高的技术也逐步在MRD监测中进行了应用,本文小编通过查阅专家共识、指南、权威文献等对MRD检测时机的建议进行整理,希望能给临床带来一些参考。
01、MRD检测方法
MRD的检测方法主要基于流式细胞术(MFC)、荧光定量PCR(qPCR)、数字PCR(dPCR)、二代测序(NGS)等。不同的检测技术在灵敏度及适用性方面均存在一定的差异,基于NGS技术(免疫组库测序)的MRD检测灵敏度可以达到10-6[11],相比传统的MFC检测方法高出至少100倍,并且特异性、准确性更高,近些年也已被纳入国内外指南推荐中[8,12-19,25]。
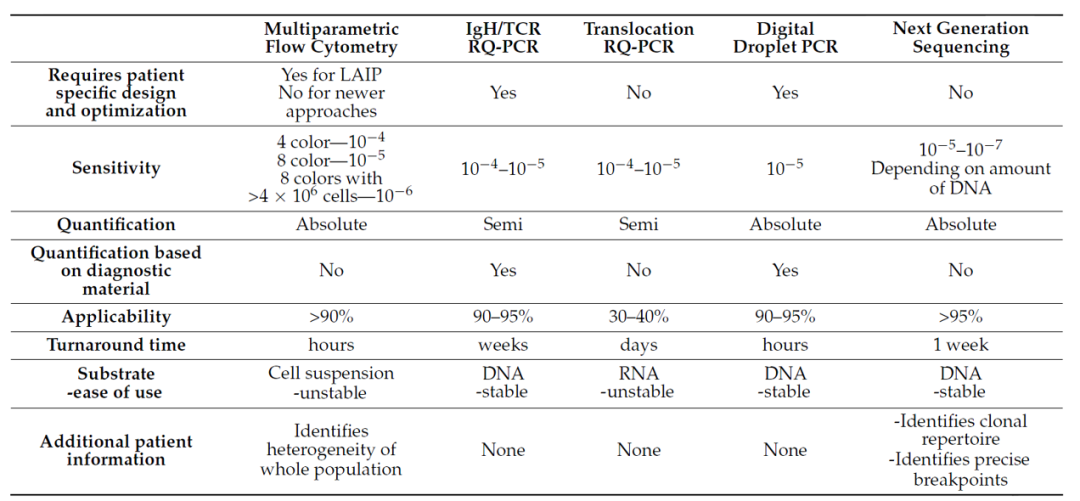
02、MRD相关共识及指导文件
MRD检测的重要性已得到国内外专家学者的广泛认可,国内及国际相关的专家共识、指导性文件近些年也陆续发布(如图2所示),对于MRD的临床应用指导给予了更好的建议。

03、MRD检测时机
急性淋巴细胞白血病(ALL)MRD检测时机建议
(1)《急性淋巴细胞白血病药物临床试验中检测微小残留病的技术指导原则》[21]中提出:在临床试验中,对于新诊断和复发难治患者至少应在首次获得血液学CR时开始MRD水平监测;对已获得血液学CR而仍需接受维持治疗或造血干细胞移植的患者应在维持治疗期间、移植前、接受新治疗前确定MRD状态,维持治疗期间至少每3个月检测一次MRD,移植患者至少在移植后第100天检测一次MRD。
(2) 《中国成人急性淋巴细胞白血病诊断与治疗指南(2021年版)》[22]中MRD检测时机的建议:ALL患者整个治疗期间都应进规范的MRD监测,并根据监测结果进行动态的危险度分层和治疗方案调整。早期在诱导治疗期间(第14天)和(或)结束时(第28天左右)行MRD检测;缓解后定期监测,尤其应保证治疗第3个月(12-16周)、第6个月(18-22周)的MRD监测。
(3) 《嵌合抗原受体T细胞治疗成人急性B淋巴细胞白血病中国专家共识(2022年版)》[23]中MRD检测时机的建议建议:嵌合抗原受体T细胞(CAR-T)治疗后前半年每1-2个月、半年后每3-6个月进行骨髓MRD监测。且推荐通过更敏感的手段如Ig高通量测序等进行MRD检测。
(4) 《NCCN急性淋巴细胞白血病临床实践指南(2023.V3)》[17]和《儿童急性淋巴细胞白血病临床实践指南(2023.V2)》[18]中对MRD检测时机的建议:①诱导治疗结束时(初治或复发);②巩固治疗结束时;③其它时间点应根据所用方案确定;④分子学复发或持续低水平疾病负荷患者可增加连续监测频率。另外需要注意的是骨髓增生不良可能会影响MRD定量检测,有些检测方案需要在血细胞计数恢复正常之后再送检MRD[18]。
(5) 《急性淋巴细胞白血病微小残留病检测与临床解读中国专家共识(2023年版)》[15]中MRD检测时机的建议:①初诊ALL患者:在初始治疗前,应留取骨髓标本作为MRD评估的基线值,诱导治疗第15天、诱导缓解后、巩固治疗后(约治疗后的3个月内),以及后期每间隔3个月应评估 MRD,直至3年。对于Ph+ALL患者如未在第1次缓解期接受移植,应至少监测MRD 3~5年。对准备接受allo-HSCT的患者,在移植前1个月内应再次评估 MRD,移植后推荐在+1、+2、+3、+4.5、+6、+9个月及+12个月的时间点监测骨髓MRD水平,移植1年后每3个月评估骨髓MRD情况直至移植后3年,期间根据病情变化酌情评估骨髓MRD。②复发/难治ALL患者:对于接受挽救治疗的复发/难治ALL患者,MRD应在形态学缓解后及治疗结束时进行评估,特别是对首次接受挽救治疗的患者意义重大。③此外,无论在接受何种治疗后,临床医师考虑患者疾病有变化时,可随即对患者进行MRD评估。
慢性淋巴细胞白血病(CLL)MRD检测时机建议
(1) CLL MRD检测:专家审查和共识”[24]中建议:对于固定持续时间的治疗,MRD检测应与最后一次治疗完成后至少2个月的反应评估相一致。对于持续治疗,应在达到最佳临床反应时检测MRD状态。建议为临床试验设计提供固定的试验时间点。
(2) 《NCCN慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(2023.V3)》[25]中提出:治疗结束后外周血中检测不到的MRD是治疗效果的重要预测指标。
(3) 《CLL微小残留病检测与临床解读中国专家共识(2023年版)》[16]中MRD检测时机的建议:推荐治疗过程中用同一方法监测:①对于化学免疫治疗及新的固定周期治疗,推荐与疗效评估同时进行,末次治疗结束后至少2个月进行;②接受持续治疗的患者,可在获得最佳临床疗效时进行,临床试验中推荐按照研究设计在固定时间点监测;③BTKi单药或联合 CD20 单抗治疗缓解深度有限,不常规开展MRD检测,在疾病稳定或缓解程度不断加深的患者中可每年定期检测;④部分缓解(PR)患者也可获得uMRD(残留的CLL细胞低于万分之一个白细胞(<10-4)被定义为uMRD),因此MRD评估不应局限于CR患者。
急性髓系白血病(AML)MRD检测时机建议
(1) 2021版《欧洲白血病网络(ELN)AML指南》[26]中对MRD检测时机的建议:①在NPM1突变的AML中,2个周期化疗后的外周血(PB),巩固结束时的骨髓(BM),巩固结束后的24个月,每3个月优先评估一次BM MRD。另外,在为期24个月的随访期间,也可以每4-6周从PB中评估一次MRD;②在RUNX1-RUNX1T1和CBFB-MYH11突变的AML中,应优先在2个化疗周期后的PB、巩固治疗结束时的BM和巩固结束后24个月每4-6周的PB中评估MRD;③使用MFC-MRD随访的患者应在2个周期化疗后、巩固结束时和干细胞移植前进行BM评估;④NGS MRD的临床应用尚不确定,但可以考虑在两个周期的强化化疗后、干细胞移植前、治疗结束时和随访期间使用BM或PB进行评估。
(2) 2022版《ELN AML指南》[27]建议MRD评估及检测时间点如图3所示。
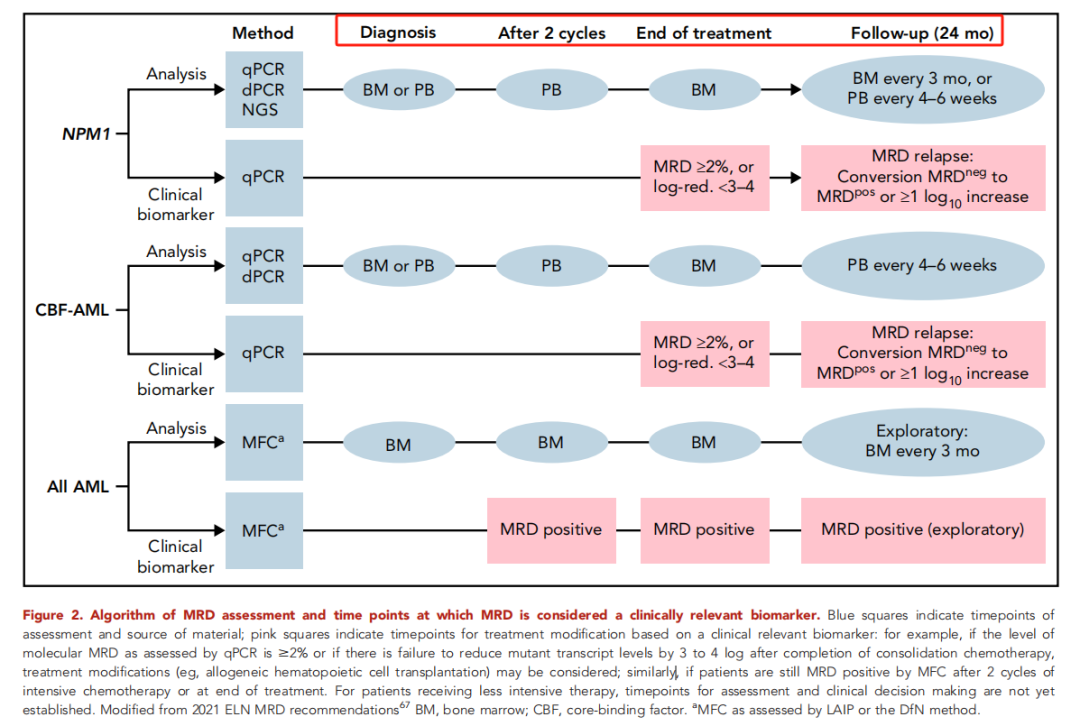
图3 2022版AML ELN指南建议MRD评估及检测时间点[27]
(3) NCCN AML临床实践指南(2023.V6)[28]中对MRD检测时机的建议:①完成初始诱导治疗后;②在异体造血干细胞移植之前;③其它时间点应根据所用方案确定(如图8)。
急性早幼粒细胞白血病(APL)MRD检测时机建议
(1) 对于高危APL,MRD应从治疗结束时开始,每3个月从BM中进行qPCR评估,持续24个月。或者,在随访期间,可以每4-6周从PB中进行一次MRD评估[26]。
(2) 2022年发布的《中国儿童急性早幼粒细胞白血病诊疗指南》[29]中对于APL MRD检测时机的建议:①诱导结束后骨髓检查重点了解是否血液学缓解,可监测或不监测MRD。②巩固结束后必须检查骨髓标本MRD,送检标本量需足够,以免出现假阴性。③巩固结束后MRD已阴性,后续MRD监测可用骨髓或外周血标本,每3~6个月复查,至少直到维持治疗完全结束后24个月。④巩固结束后MRD由阴性转为阳性,建议相隔1~2周重复检查,第2次仍阳性者可诊断分子学复发,如果第2次阴性,需再次复查。
(3) 2023年《CSCO恶性血液病诊疗指南》[8]中对于APL患者的MRD检测时机建议:采用定量PCR监测骨髓PML-RARa转录本水平,治疗期间建议2-3个月进行一次分子学反应评估,持续监测2~3年。上述融合基因持续阴性者继续维持治疗,融合基因转阳性者4周内复查。复查阴性者继续维持治疗,确实阳性者按复发处理。流式细胞术因对于APL的MRD敏感性显著小于定量PCR,因此不建议单纯采用流式细胞术对APL进行MRD监测。
慢性髓系白血病(CML)MRD检测时机建议
(1) 《慢性髓细胞白血病药物临床试验中检测微小残留病的技术指导原则》[30]中对于CML MRD检测时机提出了建议:应该至少每3个月进行一次 BCR-ABL1 mRNA 水平检测,即使受试者已经获得了主要分子学反应(MMR) 或实现无治疗缓解(TFR)。获得MMR且持续缓解时间超过24个月的受试者,可以酌情降低检测频率至每6个月一次,直至当前治疗首次给药后至少5年或丧失分子学水平反应。接受异基因造血干细胞移植的受试者应该在移植前后均进行 BCR-ABL1 mRNA水平检测。未达到最佳反应,或已达到MMR但BCR-ABL1 mRNA水平出现增高趋势的受试者,应该适当增加检测频率。未获得最佳疗效、治疗失败或出现病情进展时、加速期和急变期患者在接受治疗前应进行BCR-ABL1激酶区突变检测。
(2) 《NCCN CML临床实践指南(2024.V1)》[31]针对TKI停药标准中对MRD检测时机的建议:停药后前6个月每月均进行分子监测,第7-12个月内每两个月监测一次,之后对仍处于MMR的患者 (BCR-ABL1≤0.1% IS)每3月(无限期)进行一次监测。
多发性骨髓瘤(MM)MRD检测时机建议
(1) 《多发性骨髓瘤药物临床试验中应用微小残留病的技术指导原则》[32]中对于MM MRD检测时机提出了建议:非移植患者在达到严格完全缓解(sCR)或完全缓解(CR)时进行MRD检测;移植患者可在诱导治疗后获得最佳反应时、移植后第100天、维持治疗开始前和随访期间进行MRD检测,根据疾病缓解情况制定MRD检测的频率及时机。
(2) 《嵌合抗原受体T细胞治疗多发性骨髓瘤中国血液临床专家共识(2022年版)》[33]将MRD结果作为CAR-T治疗后全面评估的指标之一,建议:在治疗后14天、28天进行评估,半年内每月评估一次,6-12个月每2个月评估一次,第2年每3个月评估一次,第3年及以后每3-6个月或根据临床情况进行全面评估。
(3) 《NCCN 多发性骨髓瘤临床实践指南(2024.V1)》[19]中对MM MRD检测时机提出了建议:每个治疗期后进行MRD检测,如诱导治疗后、大剂量化疗/自体干细胞移植(ASCT)后、巩固治疗后、维持治疗后。应仅在疑似完全缓解时开始进行MRD检测。
淋巴瘤MRD检测时机建议
针对淋巴瘤MRD检测时机的建议,《国家卫健委发布的淋巴瘤诊疗指南(2022年版)》[34]中提到:诱导治疗达到CR的淋巴母细胞淋巴瘤(LBL)患者需进一步检测MRD,如果MRD阳性则推荐异基因造血干细胞移植(allo-HSCT),MRD阴性则推荐维持治疗或对高危患者进行allo-HSCT。
04、结语
综上所述,血液肿瘤患者治疗后MRD的定期监测非常重要。根据指南和专家共识建议来看,均推荐在血液肿瘤各治疗阶段结束达到最佳临床反应时进行MRD检测,在维持治疗期间、随访期间则可根据疾病缓解的情况制定MRD监测方案。荻硕贝肯深耕于血液病领域十年有余,业务范围覆盖血液肿瘤(包括各类白血病、多发性骨髓瘤、淋巴瘤等)诊疗全病程周期,并竭诚为临床医生、患者提供最专业的检测以及科研服务解决方案。
参考文献
[1] Mortimer J, Blinder MA, Schulman S, Appelbaum FR, Buckner CD, Clift RA, Sanders JE, Storb R, Thomas ED. Relapse of acute leukemia after marrow transplantation: natural history and results of subsequent therapy. J Clin Oncol. 1989 Jan;7(1):50-7. doi: 10.1200/JCO.1989.7.1.50. Erratum in: J Clin Oncol 1989 Apr;7(4):545. PMID: 2642540.
[2] Frassoni F, Barrett AJ, Grañena A, Ernst P, Garthon G, Kolb HJ, Prentice HG, Vernant JP, Zwaan FE, Gratwohl A. Relapse after allogeneic bone marrow transplantation for acute leukaemia: a survey by the E.B.M.T. of 117 cases. Br J Haematol. 1988 Nov;70(3):317-20. doi: 10.1111/j.1365-2141.1988.tb02488.x. PMID: 3061443.
[3] 中华医学会血液学分会实验诊断学组. 急性髓系白血病微小残留病检测与临床解读中国专家共识(2021年版) [J] . 中华血液学杂志, 2021, 42(11) : 889-897. DOI: 10.3760/cma.j.issn.0253-2727.2021.11.002.
[4] Schnittger S, Kern W, Tschulik C, Weiss T, Dicker F, Falini B, Haferlach C, Haferlach T. Minimal residual disease levels assessed by NPM1 mutation-specific RQ-PCR provide important prognostic information in AML. Blood. 2009 Sep 10;114(11):2220-31. doi: 10.1182/blood-2009-03-213389. Epub 2009 Jul 8. PMID: 19587375.
[5] Scarfò L, Heltai S, Albi E, Scarano E, Schiattone L, Farina L, Moia R, Deodato M, Ferrario A, Motta M, Reda G, Sancetta R, Coscia M, Rivela P, Laurenti L, Varettoni M, Perotta E, Capasso A, Ranghetti P, Colia M, Ghia P. Minimal residual disease-driven treatment intensification with sequential addition of ibrutinib to venetoclax in R/R CLL. Blood. 2022 Dec 1;140(22):2348-2357. doi: 10.1182/blood.2022016901. PMID: 35921541.
[6] Kater AP, Levin MD, Dubois J, Kersting S, Enggaard L, Veldhuis GJ, Mous R, Mellink CHM, van der Kevie-Kersemaekers AF, Dobber JA, Poulsen CB, Frederiksen H, Janssens A, Schjødt I, Dompeling EC, Ranti J, Brieghel C, Mattsson M, Bellido M, Tran HTT, Nasserinejad K, Niemann CU. Minimal residual disease-guided stop and start of venetoclax plus ibrutinib for patients with relapsed or refractory chronic lymphocytic leukaemia (HOVON141/VISION): primary analysis of an open-label, randomised, phase 2 trial. Lancet Oncol. 2022 Jun;23(6):818-828. doi: 10.1016/S1470-2045(22)00220-0. PMID: 35654052.
[7] Curran E, Stock W. Taking a “BiTE out of ALL”: blinatumomab approval for MRD-positive ALL. Blood. 2019 Apr 18;133(16):1715-1719. doi: 10.1182/blood-2018-12-852376. Epub 2019 Feb 22. PMID: 30796026; PMCID: PMC6634959.
[8] 2023 CSCO恶性血液病诊疗指南.
[9] San-Miguel J, Avet-Loiseau H, Paiva B, Kumar S, Dimopoulos MA, Facon T, Mateos MV, Touzeau C, Jakubowiak A, Usmani SZ, Cook G, Cavo M, Quach H, Ukropec J, Ramaswami P, Pei H, Qi M, Sun S, Wang J, Krevvata M, DeAngelis N, Heuck C, Van Rampelbergh R, Kudva A, Kobos R, Qi M, Bahlis NJ. Sustained minimal residual disease negativity in newly diagnosed multiple myeloma and the impact of daratumumab in MAIA and ALCYONE. Blood. 2022 Jan 27;139(4):492-501. doi: 10.1182/blood.2020010439. PMID: 34269818; PMCID: PMC8796656.
[10] Cavo M, San-Miguel J, Usmani SZ, Weisel K, Dimopoulos MA, Avet-Loiseau H, Paiva B, Bahlis NJ, Plesner T, Hungria V, Moreau P, Mateos MV, Perrot A, Iida S, Facon T, Kumar S, van de Donk NWCJ, Sonneveld P, Spencer A, Krevvata M, Heuck C, Wang J, Ukropec J, Kobos R, Sun S, Qi M, Munshi N. Prognostic value of minimal residual disease negativity in myeloma: combined analysis of POLLUX, CASTOR, ALCYONE, and MAIA. Blood. 2022 Feb 10;139(6):835-844. doi: 10.1182/blood.2021011101. PMID: 34289038; PMCID: PMC8832474.
[11] Costa LJ, Derman BA, Bal S, Sidana S, Chhabra S, Silbermann R, Ye JC, Cook G, Cornell RF, Holstein SA, Shi Q, Omel J, Callander NS, Chng WJ, Hungria V, Maiolino A, Stadtmauer E, Giralt S, Pasquini M, Jakubowiak AJ, Morgan GJ, Krishnan A, Jackson GH, Mohty M, Mateos MV, Dimopoulos MA, Facon T, Spencer A, Miguel JS, Hari P, Usmani SZ, Manier S, McCarthy P, Kumar S, Gay F, Paiva B. International harmonization in performing and reporting minimal residual disease assessment in multiple myeloma trials. Leukemia. 2021 Jan;35(1):18-30. doi: 10.1038/s41375-020-01012-4. Epub 2020 Aug 11. PMID: 32778736.
[12] 中国抗癌协会小儿肿瘤专业委员会, 中华医学会儿科学分会血液学组. 儿童血液系统疾病二代测序技术临床应用中国专家共识(2022) [J] . 中华儿科杂志, 2023, 61(1) : 23-28.
[13] 中国儿童急性淋巴细胞白血病诊疗规范(2018年版).
[14] 中国医师协会血液科医师分会,中华医学会血液学分会,中国医师协会多发性骨髓瘤专业委员会.中国多发性骨髓瘤诊治指南(2020年修订)[J].中华内科杂志 2020年59卷5期, 341-346页, MEDLINE ISTIC PKU CSCD CA,2021.
[15] 中华医学会血液学分会实验诊断学组. 急性淋巴细胞白血病微小残留病检测与临床解读中国专家共识(2023年版) [J] . 中华血液学杂志, 2023, 44(4) : 267-275. DOI: 10.3760/cma.j.issn.0253-2727.2023.04.002.
[16] 中国抗癌协会血液肿瘤专业委员会, 中华医学会血液学分会, 中国慢性淋巴细胞白血病工作组. 慢性淋巴细胞白血病微小残留病检测与临床解读中国专家共识(2023年版) [J] . 中华血液学杂志, 2023, 44(3) : 182-187. DOI:10.3760/cma.j.issn.0253-2727.2023.03.002.
[17] NCCN 急性淋巴细胞白血病临床实践指南(2023.V3).
[18] NCCN 儿童急性淋巴细胞白血病临床实践指南(2023.V2).
[19] NCCN 多发性骨髓瘤临床实践指南(2024.V1).
[20] Contreras Yametti GP, Ostrow TH, Jasinski S, Raetz EA, Carroll WL, Evensen NA. Minimal Residual Disease in Acute Lymphoblastic Leukemia: Current Practice and Future Directions. Cancers (Basel). 2021 Apr 13;13(8):1847. doi: 10.3390/cancers13081847. PMID: 33924381; PMCID: PMC8069391.
[21] 国家药品监督管理局药品审评中心(CDE).急性淋巴细胞白血病药物临床试验中检测微小残留病的技术指导原则. 2020年8月.
[22] 国抗癌协会血液肿瘤专业委员会,中华医学会血液学分会白血病淋巴瘤学组.中国成人急性淋巴细胞白血病诊断与治疗指南(2021年版)[J].中华血液学杂志, 2021,42(9):12.
[23] 中华医学会血液学分会白血病淋巴瘤学组,中国抗癌协会血液肿瘤专业委员会造血干细胞移植与细胞治疗学组.嵌合抗原受体T细胞治疗成人急性B淋巴细胞白血病中国专家共识(2022年版)[J].中华血液学杂志, 2022, 43(2):7. DOI:10.3760/cma.j.issn.0253-2727.2022.02.001.
[24] Wierda WG, Rawstron A, Cymbalista F, Badoux X, Rossi D, Brown JR, Egle A, Abello V, Cervera Ceballos E, Herishanu Y, Mulligan SP, Niemann CU, Diong CP, Soysal T, Suzuki R, Tran HTT, Wu SJ, Owen C, Stilgenbauer S, Ghia P, Hillmen P. Measurable residual disease in chronic lymphocytic leukemia: expert review and consensus recommendations. Leukemia. 2021 Nov;35(11):3059-3072. doi: 10.1038/s41375-021-01241-1. Epub 2021 Jun 24. PMID: 34168283; PMCID: PMC8550962.
[25] NCCN 慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(2023.V3).
[26] Heuser M, Freeman SD, Ossenkoppele GJ, Buccisano F, Hourigan CS, Ngai LL, Tettero JM, Bachas C, Baer C, Béné MC, Bücklein V, Czyz A, Denys B, Dillon R, Feuring-Buske M, Guzman ML, Haferlach T, Han L, Herzig JK, Jorgensen JL, Kern W, Konopleva MY, Lacombe F, Libura M, Majchrzak A, Maurillo L, Ofran Y, Philippe J, Plesa A, Preudhomme C, Ravandi F, Roumier C, Subklewe M, Thol F, van de Loosdrecht AA, van der Reijden BA, Venditti A, Wierzbowska A, Valk PJM, Wood BL, Walter RB, Thiede C, Döhner K, Roboz GJ, Cloos J. 2021 Update on MRD in acute myeloid leukemia: a consensus document from the European LeukemiaNet MRD Working Party. Blood. 2021 Dec 30;138(26):2753-2767. doi: 10.1182/blood.2021013626. PMID: 34724563; PMCID: PMC8718623.
[27] Döhner H, Wei AH, Appelbaum FR, Craddock C, DiNardo CD, Dombret H, Ebert BL, Fenaux P, Godley LA, Hasserjian RP, Larson RA, Levine RL, Miyazaki Y, Niederwieser D, Ossenkoppele G, Röllig C, Sierra J, Stein EM, Tallman MS, Tien HF, Wang J, Wierzbowska A, Löwenberg B. Diagnosis and management of AML in adults: 2022 recommendations from an international expert panel on behalf of the ELN. Blood. 2022 Sep 22;140(12):1345-1377. doi: 10.1182/blood.2022016867. PMID: 35797463.
[28] NCCN 急性髓系白血病(2023.V6).
[29] 中国抗癌协会小儿肿瘤专业委员会.中国儿童急性早幼粒细胞白血病诊疗指南[J].中华实用儿科临床杂志,2022,37(2):81-88.DOI:10.3760/cma.j.cn101070-20211103-01309.
[30] 国家药品监督管理局药品审评中心(CDE). 慢性髓细胞白血病药物临床试 验中检测微小残留病的技术指导原则.2021年11月.
[31] NCCN慢性髓系白血病临床实践指南(2024.V1).
[32] 国家药品监督管理局药品审评中心(CDE). 多发性骨髓瘤药物临床试验中应用微小残留病的技术指导原则.2021年11月.
[33] 中国医师协会血液科医师分会,中华医学会血液学分会.嵌合抗原受体T细胞治疗多发性骨髓瘤中国血液临床专家共识(2022年版)[J].中华血液学杂志, 2022, 43(04):265-271.DOI:10.3760/cma.j.issn.0253-2727.2022.04.001.
[34] 国家卫健委. 淋巴瘤诊疗指南(2022年版).
(本网站所有标识“原创”的内容,均为荻硕贝肯原创,版权均归荻硕贝肯所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:荻硕贝肯官网”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)

