
新闻中心
【原创】单细胞测序技术在CAR-T治疗急性淋巴白血病中的应用
CART19细胞疗法作为一种潜在的免疫治疗方法,在治疗B细胞恶性肿瘤方面取得了显著成果。70% ~ 90% 的B-ALL患者在接受CART19产品后达到完全缓解。然而,一部分患者的缓解是短暂的,30% ~ 60% 的治疗患者在1年内复发,其中很大一部分是CD19阳性的患者[1-3]。这些在治疗效果上的差异引起了研究者对CAR-T细胞治疗获得耐药性分子机制的探索。基于此,研究者通过CAR-T激活状态的单细胞多组学分析,为CD19阳性复发背后的分子特征提供了新的见解。
01、案例解析
英文标题:Single-cell antigen-specific landscape of CAR T infusion product identifies determinants of CD19-positive relapse in patients with ALL[4]
中文标题:CAR-T输液产品的单细胞抗原特异性特征是识别ALL患者CD19阳性复发的决定因素
研究对象:持久响应患者(CR,N=5)、复发患者(RL,N=5)、非应答患者(NR,N=2)
发表期刊:SCIENCE ADVANCES
发表时间:2022年
影响因子:14.957
运用生物技术:scRNA-Seq、CITE-Seq、流式细胞术
研究设计
研究者分析了来自12名急性淋巴细胞白血病患者输注前的CART19产品。研究开始前,首先利用表达特异抗原CD19的抗原呈递细胞(CD19-3T3细胞)进行刺激CAR-T细胞,设计三种不同的刺激条件:表达非特异性抗原间皮素mesothelin的细胞刺激;TCR介导的刺激;不刺激(图1)。研究者通过单细胞测序和14个表面蛋白的CITE-Seq测序对不同刺激条件下的CAR-T细胞进行分析。
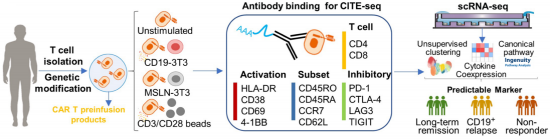
图1 实验设计
研究结果
1. 发现与患者持久响应相关的细胞因子TH2
对患者的scRNA-seq数据进行整合和聚类,确定了11个具有不同转录组特征的亚群(图2A)。单细胞测序结果显示:受刺激与未刺激CAR-T细胞分离,并且MSLN-3T3共培养的细胞与未刺激的细胞重叠(图2B)。分析差异基因表达发现在CAR或TCR刺激下,大量的细胞因子CSF2、IFNG、IL2、IL13、CCL3、CCL4、XCL1和XCL2高表达。尤其是在CD19-3T3细胞或抗CD3/CD28磁珠刺激下,所有患者的CSF2+ CAR-T细胞比例均显著增加。所以,CSF2+ CAR-T细胞被鉴定为处于功能活性状态的CAR-T细胞。研究者进行无监督分析,确定了多个功能性细胞因子共表达模块,包括两个1型细胞因子模块(如IFNG和IL2),2型细胞因子模块(如IL4,IL5,IL9,IL13和IL31),以及一个β趋化因子(如CCL3,CCL4)和相关因子(图2C)。在主要反应状态下,CR、RL和NR患者的CAR-T细胞定位不同区域(图2D),表明这些细胞具有独特的细胞因子模块表达谱。值得注意的是,2型(TH2)模块主要富集在CR患者的细胞区域内(图2E-F)。这意味着TH2细胞因子在CAR-T治疗中维持长期缓解是不可或缺的。
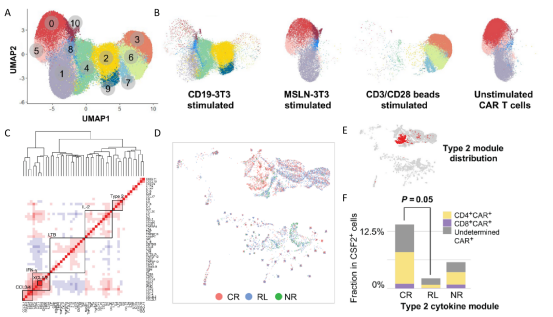
图2 单细胞测序分析CAR-T细胞
2. 在CR患者的CAR-T细胞中,TH2功能相关通路、基因和上游调控因子共同上调
研究者通过比较抗原特异性刺激下CR和RL患者的CAR-T细胞,发现CR患者中与TH2相关细胞因子的基因上调,如IL4、IL5和IL13(图3A)。为了探索上游调控因子的级联反应,研究者进行了IPA上游分析。分析显示GATA3作为一种介导TH2特征基因激活的主转录因子,以及一些参与T细胞激活的基因,包括NFKB1、NFATC2、TNF、CD28和CD69,在CR患者中表达显著上调(图3B)。分析CR和RL患者中IL13、IL5、IL4和GATA3的表达显示,这4个基因在CR患者中普遍高表达(图3C)。
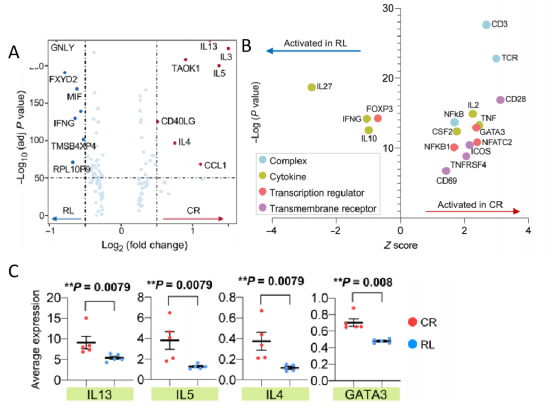
图3 TH2功能相关通路、基因和上游调控因子在CR患者中共同上调
3. 进一步实验验证TH2细胞因子与患者预后的关系
为了进一步验证实验结果,将49名B-ALL患者纳入了细胞治疗实验中,通过流式细胞术和多重分泌组学进行分析(图4A)。流式细胞结果显示CR患者中TH2的CAR-T细胞数量显著高于RL患者(图4B)。对TH2相关细胞因子的分析显示,除了IL-13外其他的细胞因子在CR患者和RL患者之间存在显著差异(图4C)。多重分泌组学分析细胞因子,使用功能强度指数(FSI)来描述CAR-T细胞的特定功能谱。研究发现CR患者的TH2 FSI明显高于RL患者(图4D)。这些数据表明了TH2功能缺陷导致了CD19的阳性复发。
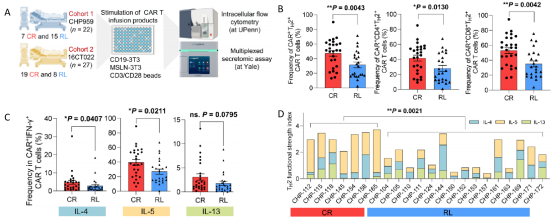
图4 独立实验验证RL患者中TH2功能的缺陷
4. 记忆性和效应性CAR-T细胞比例可以预测CD19阳性的复发
表型蛋白质组学分析显示,对于未受刺激CAR-T细胞,CR患者中记忆性CAR-T细胞(TSCM和TCM)的比例显著较高,而效应CAR-T细胞(TEM)的比例较低(图6A-B)。在CAR刺激下,RL患者的TSCM和TCM细胞表达较低(图6C-D)。进一步的验证实验也证实,CR患者中记忆性CAR-T细胞显著高于RL患者(图6E)。这些不同的记忆性和效应性CAR-T细胞比例可以预测CD19阳性的复发。

图5 表型蛋白质组学分析CAR-T细胞
5. 建立一个综合模型预测CAR-T细胞治疗效果
研究者综合了三种主要的生物标志物:TH2表达水平,TH2表达频率,记忆-效应细胞比,作为单一指标来构建模型预测患者持久响应(图6A)。这一模型根据综合指数成功区分CR和RL患者,达到约70%的灵敏度,假阳性率为<5%(图6B)。由此表明,这一模型在预测接受CAR-T治疗患者的持久响应或CD19阳性复发方面的可行性。
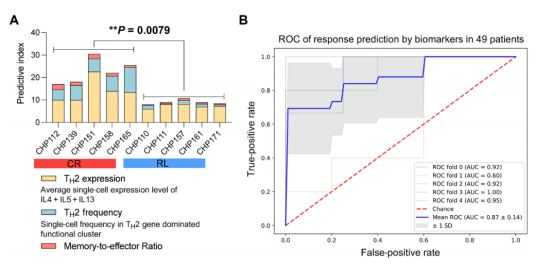
图6 建立一个综合模型预测CAR-T细胞治疗效果
小结
单细胞测序技术发现CAR-T细胞的质量指标,并且可以发现关键的细胞亚群和分子信号。在未来,利用单细胞测序技术可能会识别多个靶点抗原的组合,也会越来越多地应用于实体瘤的研究。
02、结语
单细胞转录组测序技术正以迅猛的发展势头广泛运用于生命科学研究中。未来,高通量单细胞转录组研究也会为科学研究带来更多的成果和产出。
荻硕贝肯已开展检测服务10年多,拥有质谱、二代测序、数字PCR、荧光PCR、流式细胞仪等平台,可开展从DNA–>RNA–>蛋白质–>代谢组层面完善的系统生物学研究,并定制个性化分析服务,满足客户需求。
参考文献
1.R. A. Gardner, O. Finney, C. Annesley, H. Brakke, C. Summers, K. Leger, M. Bleakley, C. Brown,S. Mgebroff, K. S. Kelly-Spratt, V. Hoglund, C. Lindgren, A. P. Oron, D. Li, S. R. Riddell,J. R. Park, M. C. Jensen, Intent-to-treat leukemia remission by CD19 CAR T cells of defined formulation and dose in children and young adults. Blood 129, 3322–3331 (2017).
2. S. L. Maude, T. W. Laetsch, J. Buechner, S. Rives, M. Boyer, H. Bittencourt, P. Bader, M. R. Verneris,H. E. Stefanski, G. D. Myers, M. Qayed, B. de Moerloose, H. Hiramatsu, K. Schlis, K. L. Davis, P. L. Martin, E. R. Nemecek, G. A. Yanik, C. Peters, A. Baruchel, N. Boissel, F. Mechinaud, A. Balduzzi, J. Krueger, C. H. June, B. L. Levine, P. Wood, T. Taran, M. Leung, K. T. Mueller, Y. Zhang, K. Sen, D. Lebwohl, M. A. Pulsipher, S. A. Grupp, Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. N. Engl. J. Med. 378, 439–448 (2018).
3. C. J. Turtle, L.-A. Hanafi, C. Berger, T. A. Gooley, S. Cherian, M. Hudecek, D. Sommermeyer, K. Melville, B. Pender, T. M. Budiarto, E. Robinson, N. N. Steevens, C. Chaney, L. Soma, X. Chen, C. Yeung, B. Wood, D. Li, J. Cao, S. Heimfeld, M. C. Jensen, S. R. Riddell, D. G. Maloney, CD19 CAR-T cells of defined CD4+:CD8+ composition in adult B cell ALL patients. J. Clin. Invest. 126, 2123–2138 (2016).
4.Bai Z, Woodhouse S, Zhao Z, Arya R, Govek K, Kim D, Lundh S, Baysoy A, Sun H, Deng Y, Xiao Y, Barrett DM, Myers RM, Grupp SA, June CH, Fan R, Camara PG, Melenhorst JJ. Single-cell antigen-specific landscape of CAR T infusion product identifies determinants of CD19-positive relapse in patients with ALL. Sci Adv. 2022 Jun 10;8(23):eabj2820. doi: 10.1126/sciadv.abj2820. Epub 2022 Jun 8. PMID: 35675405; PMCID: PMC9177075.
(本网站所有标识“原创”的内容,均为荻硕贝肯原创,版权均归荻硕贝肯所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:荻硕贝肯官网”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)

