
新闻中心
造血干细胞移植后TA-TMA早期预测生物标志物
造血干细胞移植相关的血栓性微血管病(TA-TMA)是一种移植后严重的全身性并发症,常表现为不受控制的微血管病性溶血性贫血(MAHA),伴有持续性裂红细胞增多、溶血标志物升高、血小板减少和微血管血栓形成,导致肾脏和其他器官的缺血性损伤[1,2]。TA-TMA也是非复发死亡(NRM)的一个重要因素,并与移植后较差的生存率相关[3]。早期阻断内皮损伤可能是防治TA-TMA的关键,早期发现TA-TMA很重要[4]。研究表明TA-TMA潜在的生物标志物包括可溶性选择素、内皮损伤标志物、炎症细胞因子、sC5b-9以外的补体级联成分或血栓标志物等(如图1所示)[5]。那么,关于TA-TMA的早期预测生物标志物有哪些?
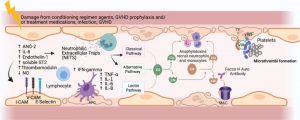 图1 TA-TMA潜在的生物标志物
图1 TA-TMA潜在的生物标志物
01 sC5b-9水平早期增加预测TA-TMA
sC5b-9作为可溶性补体膜攻击复合物,是补体途径激活的标志物(图2)[6],被纳为TA-TMA的诊断指标之一,联合蛋白尿升高提示预后较差,需及早干预[7]。等通过对67例接受异基因造血干细胞移植的儿科患者进行研究(移植前和移植后第28天、56天、100天系统测量补体途径活性、组分和sC5b-9水平)[8]发现sC5b-9水平早期增加(第28天相较于基线)与移植后100天内TA-TMA的发生具有强而显著的关系(P = 0.002)(图3)。当计算第28天和第0天sC5b-9值的绝对差值时,ROC分析确定66 ng/ml的增加量是识别TA-TMA患者的最优阈值,其敏感性为90%,特异性为84%(AUC:0.869;95% CI 0.776–0.963),阴性预测值100%,阳性预测值27%。因此,sC5b-9的早期升高是后续发生TA-TMA的预测生物标志物。对于那些sC5b-9水平有显著增加的患者,应尝试进行早期且频繁的监测,以便及时做出后续治疗决策。

图2 补体系统激活途径

图3 移植后TA-TMA的发生与sC5b-9从基线至第28天的变化相关
02 Ba因子早期高水平预测TA-TMA
Ba是补体因子B裂解后的产物,当补体旁路途径异常激活时,Ba片段就像失控的齿轮,持续驱动扩增环运转,导致微血管内皮损伤可能呈指数级恶化(如图2所示)。
Okamura H等通过单中心巢式病例对照研究[9](15例TA-TMA成人恶性血液病患者和15例非TA-TMA成人恶性血液病患者;移植前、移植后7天、28天、60天采样进行补体相关检测)发现TA-TMA患者在异基因造血干细胞移植后第7天的Ba蛋白水平异常且显著高于非TA-TMA患者(图4),且移植后第7天Ba作为TA-TMA预测因素的ROC曲线下面积(AUC)为0.88,Ba蛋白水平的阈值为869.1 ng/ml(图5),其阳性预测值(PPV)为100%,灵敏度为80%,特异性为100%。因此,异基因造血干细胞移植后第7天Ba蛋白水平是TA-TMA的有效预测生物标志物,可在更早的时间帮助临床识别TA-TMA的可能。
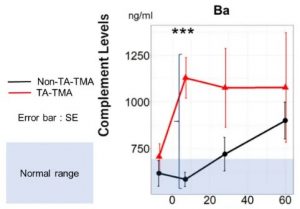
图4 TA-TMA患者与非TA-TMA患者的Ba蛋白水平变化 
图5 移植后第7天Ba蛋白水平预测TA-TMA的ROC曲线(阈值为869.1 ng/ml)
03 IL-6高水平预测TA-TMA
细胞因子在补体激活和内皮细胞活化过程中起着关键作用,尤其是白细胞介素-6(IL-6)作为一种促炎细胞因子可能激活内皮细胞。该团队通过对44例确诊TA-TMA患者(TA-TMA发病的中位时间为造血干细胞移植后 61.5 天)和44例非TA-TMA患者研究,发现IL-6水平超过正常上限(ULN)的2倍(P=0.002)是TA-TMA的独立危险因素(表1)。因此,IL-6是一种有前景的TA-TMA预测生物标志物。

表1 TA-TMA的预测因素分析
04 总结
综上所述,终末途径激活标志物sC5b-9[8]、补体因子B裂解产物Ba[9]、细胞因子IL-6[2]均有可能作为临床上有用的生物标志物来预警HSCT后TA-TMA的发生,从而帮助临床更好的管理受影响患者。期待更多相关的探索以期更好的改善患者的移植结局。
参考文献:
1. Li A, Sartain SE. Transplant-associated TMA: the conundrum of diagnosis and treatment. Hematology Am Soc Hematol Educ Program. 2024 Dec 6;2024(1):206-213. DOI: 10.1182/hematology.2024000545.
2. Zheng R, Li L, Zhao J, et al. High level serum IL-6 predicts occurrence of TA-TMA. Bone Marrow Transplant. 2025 Mar;60(3):400-402. DOI: 10.1038/s41409-024-02478-x.
3. Acosta-Medina AA, Sridharan M, Go RS, et al. Clinical Outcomes and Treatment Strategies of Adult Transplant-Associated Thrombotic Microangiopathy: External Validation of Harmonizing Definitions and High-Risk Criteria. Am J Hematol. 2025 May;100(5):830-839. DOI: 10.1002/ajh.27651.
4. Zhou X, Ye Y, Jin A, et al. Development and implementation of evidence-based, nurse-leading early warning model and healthcare quality improvement project for transplant-associated thrombotic microangiopathy: a mixed-methods, before-and-after study. BMC Nurs. 2024 Aug 7;23(1):535. DOI: 10.1186/s12912-024-02093-7.
5. Schoettler ML, Carreras E, Cho B, et al. Harmonizing Definitions for Diagnostic Criteria and Prognostic Assessment of Transplantation-Associated Thrombotic Microangiopathy: A Report on Behalf of the European Society for Blood and Marrow Transplantation, American Society for Transplantation and Cellular Therapy, Asia-Pacific Blood and Marrow Transplantation Group, and Center for International Blood and Marrow Transplant Research. Transplant Cell Ther. 2023 Mar;29(3):151-163. DOI: 10.1016/j.jtct.2022.11.015.
6. Ohtani K. Complement-Related Proteins and Their Measurements: The Current Status of Clinical Investigation. Nephron. 2020;144 Suppl 1:7-12. DOI: 10.1159/000512494.
7. 中华医学会血液学分会造血干细胞应用学组. 造血干细胞移植相关血栓性微血管病诊断和治疗中国专家共识(2021年版)[J]. 中华血液学杂志,2021,42(03):177-184.
8. Mezö B, Horváth O, Sinkovits G, Veszeli N, Kriván G, Prohászka Z. Validation of Early Increase in Complement Activation Marker sC5b-9 as a Predictive Biomarker for the Development of Thrombotic Microangiopathy After Stem Cell Transplantation. Front Med (Lausanne). 2020 Oct 6;7:569291. DOI: 10.3389/fmed.2020.569291.
9. Okamura H, Nakamae H, Shindo T, et al. Early Elevation of Complement Factor Ba Is a Predictive Biomarker for Transplant-Associated Thrombotic Microangiopathy. Front Immunol. 2021 Jul 13;12:695037. DOI: 10.3389/fimmu.2021.695037.

